Advertisements
Advertisements
Question
संश्लेषित आयन विनिमयक विधि द्वारा कठोर जल के मृदुकरण के सिद्धांत एवं विधि की विवेचना कीजिए।
Solution
संश्लेषित आयन विनिर्मयक विधि (Synthetic lon-Exchange Method) - संश्लेषित आयन विनिमयक विधि द्वारा जल में विद्यमान कठोरता के लिए उत्तरदायी आयनों को उन अन्य आयनों द्वारा प्रतिस्थापित कर दिया जाता है जो जल की कठोरता के लिए उत्तरदायी नहीं होते। इस विधि में दो प्रकार के आयन विनिमयक प्रयोग किए जाते हैं–
- अकार्बनिक आयन विनिमयक तथा
- कार्बनिक आयन विनिमयक
1. अकार्बनिक आयन विनिमयक : परम्यूटिट विधि (Inorganic lon-Exchanger : Permutit Method) - इस विधि को ‘जिओलाइट/परम्यूटिट विधि’ भी कहते हैं। यह व्यापारिक मात्रा में कठोर जल को मृदु करने की विधि है। इस विधि में सोडियम जिओलाइट का प्रयोग किया जाता है। यह वास्तव में सोडियम ऐलुमिनियम सिलिकेट नामक पदार्थ है। इसका सूत्र (Na2Al2Si2O8) है। यह या तो प्राकृतिक रूप से प्राप्त होता है अथवा इसे सोडे की राख (Na2CO3), सिलिका (SiO2) तथा ऐलुमिना (Al2O3) के मिश्रण से कृत्रिम रूप से बनाया जा सकता है। इस मिश्रण के संगलित पदार्थ को जल से धोकर शेष बचे छिद्रित पदार्थ को ही परम्यूटिट कहते हैं। सरलता की दृष्टि से ऐलुमिनियम सिलिकेट अथवा जिओलाइट आयन (Al2Si2O8) के स्थान पर ‘Z’ लिखकर सोडियम जियोलाइट को Na2Z सूत्र द्वारा प्रदर्शित किया जाता है। परम्यूटिट विधि से दोनों प्रकार की कठोरता दूर कर सकते हैं। सोडियम जियोलाइट में उपस्थित सोडियम लवणों का यह गुण है कि ये अन्य आयनों द्वारा विस्थापित हो जाते हैं।परम्युटिट को एक विशेष बेलनाकार पात्र में रखते हैं जिसमें मोटी रेत तथा परम्यूटिट भरा होता है। कठोर जल को इसमें से प्रवाहित करते हैं तो जल में उपस्थित कैल्सियम तथा मैग्नीशियम के लवण इसके साथ क्रिया करते हैं। सोडियम परमाणुओं के स्थान पर कैल्सियम या मैग्नीशियम परमाणु आ जाते हैं तथा कैल्सियम या गैग्नीशियम परम्यूटिट बन जाता है।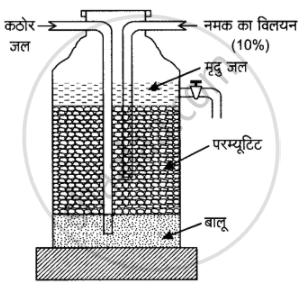
परम्यूटिट विधि से कठोर जल को मृदु बनाना।
\[\ce{Na2Al2Si2O8 + CaCl2 -> CaAl2Si2O8 + 2NaCl}\]
अथवा
\[\ce{\underset{\text{कैल्सियम बाइकार्बोनेट सोडियम परम्यूटिट}}{Ca(HCO3)2 + Na2Z} -> \underset{\text{कैल्सियम परम्यूटिट}}{CaZ\downarrow} + \underset{\text{सोडियम बाइकार्बोनेट}}{2NaHCO3}}\]
\[\ce{\underset{\text{कैल्सियम क्लोराइड सोडियम परम्यूटिट}}{CaCl2 + Na2Z} -> \underset{\text{कैल्सियम परम्यूटिट}}{CaZ\downarrow} + \underset{\text{सोडियम क्लोराइड}}{2NaCl}}\]
\[\ce{\underset{\text{मैग्नीशियम सल्फेट सोडियम परम्यूटिट}}{MgSO4 + Na2Z} -> \underset{\text{मैग्नीशियम परम्यूटिट}}{MgZ\downarrow} + \underset{\text{सोडियम सल्फेट}}{Na2SO4}}\]
वह जल जो परम्यूटिट परत से ऊपर उठता है, वह Ca2+ व Mg2+ आयनों से मुक्त होता है; अतः वह मृदु जल होता है जिसे पाइप द्वारा बाहर निकाला जा सकता है।
परम्यूटिट का पुनःनिर्माण (Regeneration of permutit) - कुछ समय बाद सम्पूर्ण Na2Z, CaZ व MgZ में परिवर्तित हो जाता है, परन्तु परम्यूटिट लंबे समय तक कार्य नहीं करता। Na2Z के पुनर्निर्माण के लिए कठोर जल के प्रवेश को रोककर इसके स्थान पर 10% NaCl विलयन मिला दिया जाता है, तब Ca2+ वे Mg2+ आयन Na+ आयनों द्वारा प्रतिस्थापित हो जाते हैं जिससे परम्यूटिट को पुनःनिर्माण हो जाता है।
\[\ce{\underset{\text{कैल्सियम परम्यूटिट सोडियम क्लोराइड}}{CaZ + 2NaCl} -> \underset{\text{कैल्सियम क्लोराइड}}{CaCl2} + \underset{\text{सोडियम परम्यूटिट}}{Na2Z}}\]
\[\ce{\underset{\text{मैग्नीशियम परम्यूटिट सोडियम क्लोराइड}}{MgZ + 2NaCl} -> \underset{\text{मैग्नीशियम क्लोराइड}}{MgCl2} + \underset{\text{सोडियम परम्यूटिट}}{Na2Z}}\]
Ca2+ व Mg2+ आयन जल द्वारा धो दिए जाते हैं तथा पुनर्निर्मित परम्यूटिट का उपयोग पुनः कठोर जल को मृदु करने में किया जा सकता है।
2. कार्बनिक आयन विनिमयक : संश्लेषित रेजिन विधि (Organic lon-Exchanger : Synthetic Resin Method) - आजकल इस आधुनिक विधि का प्रयोग काफी हो रहा है। परम्यूटिट केवल उन लवण के धनायनों (Ca2+ व Mg2+ ) को हटाता है जो जल को कठोर बनाते हैं। कार्बनिक रसायनज्ञों ने कुछ विशेष पदार्थ विकसित किए हैं, इन्हें आयन विनिमयक रेजिन (ion-exchanger resins) कहते हैं। ये लवण में उपस्थित ऋणायनों को भी हटा सकते हैं जो धनायनों की भाँति ही जल की कठोरता के लिए उत्तरदायी होते हैं। इस विधि से जल के मृदुकरण में निम्नलिखित दो प्रकार की रेजिन प्रयोग की जाती है-
i. ऋणायन-विनिमयक रेजिन (Anion-exchanger resins) - वे रेजिन ऋणायन विनिमयक रेजिन कहलाते हैं जिनमें हाइड्रोकार्बन समूह के साथ क्षारीय समूह -OH अथवा -NH2 जुड़े रहते हैं जिन्हें -OH रेजिन के रूप में प्रदर्शित किया जाता है।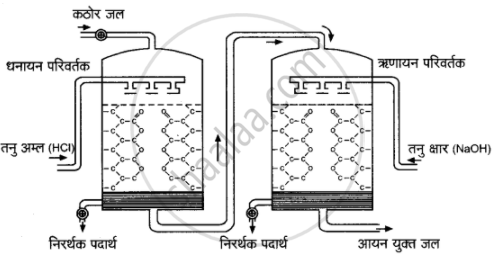
आयन-विनिमय रेजिन द्वारा जल की कठोरता का निवारण
ii. धनायन-विनिमयक रेजिन (Cation-exchanger resins) - ये हाइड्रोजन समूह ही हैं जिनके साथ अम्लीय समूह; जैसे-
—COOH या —SO3H समूह जुड़े रहते हैं तथा इन्हें धनायन विनिमयक रेजिन (H+ रेजिन) कहते हैं।
धनायन रेजिन, जल की कठोरता के उत्तरदायी धनायनों का विनिमय करते हैं, जबकि ऋणायन रेजिन, कठोरता के लिए उत्तरदायी ऋणायनों को हटाते हैं।
इसमें एक टंकी को एक रेजिन R– से लगभग आधा भरकर उसमें ऊपर से जल प्रवाहित करते हैं। रेजिन धनायनों को अवशोषित कर लेता है तथा टंकी से बाहर निकलने वाले जल में कैल्सियम और मैग्नीशियम धनायन नहीं होते; अत: जल मृदु हो जाता है। यह जल अलवणीकृत जल या अनआयनीकृत जल (demineralised water or deionised water) कहलाता है।
इसके पश्चात् इस मृदु जल को दूसरे ऐसे रेजिन R* में प्रवाहित करते हैं जो ऋणायनों को अवशोषित कर लेता है। कार्यविधि (Working procedure)-रेजिन R+ में विशाल कार्बनिक अणु होते हैं तथा उनमें अम्लीय क्रियात्मक समूह (—COOH, कार्बोक्सिलिक समूह) सम्मिलित रहते हैं। कठोर जल में उपस्थित धनायन Ca2+, Mg2+ इन अम्लीय क्रियात्मक समूहों द्वारा अवशोषित कर लिए जाते हैं तथा अम्ल से जल में H+ आयन आ जाते हैं।
\[\ce{\underset{\text{रेजिन}}{Ca^2+ + 2RCOOH} -> (RCOO)2Ca + 2H+}\]
\[\ce{\underset{(\text{रेजिन}R^-)}{Mg^{2+} + 2RCOOH} + (R^-) -> (RCOO)_2Mg + 2H+}\]
अब पात्र में से जो जल निकलता है, वह धनायनों से मुक्त होता है, परंतु इसमें ऋणात्मक आयन होते हैं। रेजिन R+ में विशाल कार्बनिक अणुओं के बीच विस्थापित अमोनियम हाइड्रॉक्साइड के दाने होते हैं जिनसे क्रियात्मक हाइड्रॉक्सिल समूह (OH–) संलग्न रहते हैं। कठोर जल में उपस्थित लवणों के ऋण विद्युती आयन, रेजिन R+ के अमोनियम आयनों \[\ce{(NH^+_4)}\] से संयुक्त हो जाते हैं।
\[\ce{\underset{(\text{रेजिन} R^+)}{RNH3OH} + Cl- + H+ -> RNH3Cl + H2O}\]
\[\ce{2RNH3OH + SO^2-_4 + 2H+ -> (RNH3)2SO4 + 2H2O}\]
H+ आयन; जो धनायन रेजिन टैंक से आते हैं, इन OH– आयनों के साथ जुड़कर जल-अणु बना लेते हैं। अतः इस प्रकार प्राप्त जल उन सभी आयनों से मुक्त होता है जो कि जल को कठोर बनाते हैं।
रेजिन का पुनःनिर्माण (Regeneration of resins) - कुछ समय बाद दोनों टैंकों में उपस्थित रेजिन पूर्णतया समाप्त हो जाते हैं; क्योंकि H+ व OH– पूरी तरह प्रतिस्थापित हो जाते हैं। वे लंबे समय तक जल की कठोरता को दूर नहीं कर सकते। इन्हें पुनः प्राप्त करने के लिए कठोर जल का प्रवेश रोक देते हैं। प्रथम टैंक में तनु HCl की धारा प्रवाहित करते हैं। अम्ल के H+ आयन्स समाप्त हो चुके रेजिन (exhausted resin) में Ca2+ व Mg2+ को प्रतिस्थापित कर H+, रेजिन का निर्माण करते हैं।
\[\ce{\underset{\text{(समाप्त हो चुका रेजिन)}}{(RCOO)2Ca} + 2HCl -> \underset{\text{(पुनर्निमित रेजिन)}}{CaCl2 + 2RCOOH}}\]
\[\ce{\underset{\text{(समाप्त हो चुका रेजिन)}}{(RCOO)2Mg} + 2HCl -> \underset{\text{(पुनर्निमित रेजिन)}}{MgCl2 + 2RCOOH}}\]
इसी प्रकार दूसरे टैंक में समाप्त हो चुके रेजिन को तनु सोडियम हाइड्रॉक्साइड विलयन में प्रवेश करा कर पुनर्निर्मित किया जा सकता है।
\[\ce{\underset{\text{(समाप्त हो चुका रेजिन)}}{RNH3Cl} + NaOH -> \underset{\text{(पुनर्निमित रेजिन)}}{RNH3OH} + NaCl}\]
\[\ce{\underset{\text{(समाप्त हो चुका रेजिन)}}{(RNH3)2SO4} + 2NaOH -> \underset{\text{(पुनर्निमित रेजिन)}}{2RNH3OH} + Na2SO4}\]
जब दोनों टैंकों में रेजिन पुनर्निर्मित हो जाता है तो अम्ल व क्षारक का प्रवेश रोक दिया जाता है। इनके स्थान पर पुन: धनायन रेजिन टैंक में कठोर जल को प्रवेश कराया जाता है। इस प्रकार एकान्तर क्रम में क्रियाएँ चलती रहती हैं तथा मृदु जल प्राप्त होता रहता है।
APPEARS IN
RELATED QUESTIONS
जल के स्वतः प्रोटोनीकरण से आप क्या समझते हैं? इसका क्या महत्त्व है?
F2 के साथ जल की अभिक्रिया में ऑक्सीकरण तथा अपचयन के पदों पर विचार कीजिए एवं बताइए कि कौन-सी स्पीशीज़ ऑक्सीकृत/अपचयित होती है?
बर्फ के साधारण रूप की संरचना का उल्लेख कीजिए।
जल के उभयधर्मी स्वभाव को दर्शाने वाले रासायनिक समीकरण लिखिए।
विखनिजित जल से क्या अभिक्रिया है?
विखनिजित जल कैसे प्राप्त किया जा सकता है?
जल का कौन-सा गुण इसे विलायक के रूप में उपयोगी बनाता है? यह किस प्रकार के यौगिक-
(i) घोल सकता है और
(ii) जल-अपघटन कर सकता है?
‘जल-अपघटन’ (Hydrolysis) तथा ‘जलयोजन’ (Hydration) पदों में क्या अंतर है?
H2O2 विरंजन कारक के रूप में कैसे व्यवहार करता है? लिखिए।
निम्नलिखित पद से आप क्या समझते हैं?
भाप अंगार गैस सृति अभिक्रिया
