Advertisements
Advertisements
Question
लैन्थेनॉयडों द्वारा कौन-कौन सी ऑक्सीकरण अवस्थाएँ प्रदर्शित की जाती हैं?
Solution
आवर्त सारणी के वर्ग 3 के सदस्यों से प्रत्याशित होता है कि लैन्थेनॉयडों की एकसमान +3 ऑक्सीकरण अवस्था उनकी एक विशेषता है। त्रिधनात्मक ऑक्सीकरण अवस्था 6s2 इलेक्ट्रॉन और एकाकी 5d-इलेक्ट्रॉन अथवा यदि कोई 5d-इलेक्ट्रॉन उपस्थित न हो तो f-इलेक्ट्रॉनों में से एक के उपयोग के अनुसार होती है। प्रथम तीन आयनन एन्थैल्पियों का योग अपेक्षाकृत निम्न होता है जिससे ये तत्व उच्च धनविद्युती होते हैं और तत्परता से +3 आयन बना लेते हैं। यद्यपि जलीय विलयन में तथा ठोस अवस्था में सीरियम (Ce4+) चर्तुधनात्मक तथा सैमेरियम, यूरोपियम और इटर्बियम (Sm2+, Eu2+ और Yb2+) द्विधनात्मक आयन दे सकते हैं। अन्य तत्व ठोस अवस्था में +4 अवस्था दे सकते हैं। MX3 का अपचयन न केवल MX2 अपितु विशेष स्थिति में जटिल अपचयित स्पीशीज भी दे सकता है।
लैन्थेनॉयडों के लिए +3 ऑक्सीकरण अवस्था की धारणा पर्याप्त दृढ़ हो गई है तथा अन्य ऑक्सीकरण अवस्थाओं को ‘प्रायः असंगत’ कहा जाता है। विभिन्न लैन्थेनॉयडों की ऐसी असंगत ऑक्सीकरण अवस्थाएँ अग्र प्रकार प्रदर्शित की गई हैं –
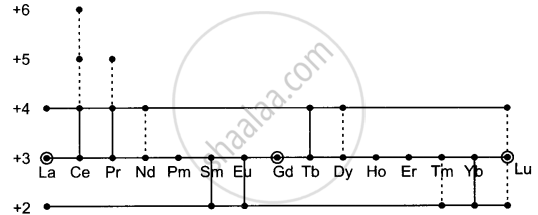
लैन्थेनम और लैन्थेनॉयड द्वारा विभिन्न ऑक्सीकरण अवस्थाएँ प्रदर्शित की जाती हैं। बिंदुवत् रेखाएँ संदिग्ध या अल्पस्थायी संयोजकताएँ प्रदर्शित करती हैं।
यदि हम यह मान लें कि रिक्त, अर्धपूर्ण या पूर्ण f-उपकोश के साथ विशेष स्थायित्व संबंधित होता है। तो एक निश्चित सीमा तक +2 तथा +4 ऑक्सीकरण अवस्थाओं की उपस्थिति का इलेक्ट्रॉनिक संरचनाओं के साथ सामंजस्य किया जा सकता है। इस प्रकार La, Gd और Lu केवल त्रिधनात्मक आयन निर्मित करते हैं क्योंकि तीन इलेक्ट्रॉनों के निष्कासन से La3+ आयन में उत्कृष्ट गैस का विन्यास बन जाता है। Gd3 तथा Lu3+ आयनों में क्रमशः स्थायी विन्यास 4f7 तथा 4f14 से इलेक्ट्रॉनों का निष्कासन नहीं होता क्योंकि M3+ आयनों की अपेक्षा M2+ अथवा M+ आयनों की जालक अथवा जलयोजन ऊर्जाएँ लघु M3+ आयनों के लवणों की योगात्मक जालक या जलयोजन ऊर्जाओं की अपेक्षा कम होगी।
सबसे अधिक स्थायी द्वि या चतुर्धनात्मक आयन उन तत्वों द्वारा निर्मित होते हैं जो ऐसा करके f9, f7 तथा f14 विन्यास प्राप्त कर सकते हों। इस प्रकार सीरियम +4 ऑक्सीकरण अवस्था में आकर f0 विन्यास प्राप्त कर लेता है। यूरोपियम तथा इटर्बियम +2 ऑक्सीकरण अवस्था में क्रमशः f7 तथा f14 विन्यास प्राप्त कर लेते हैं। ये तथ्य इस धारणा का समर्थन करते प्रतीत होते हैं कि लैन्थेनॉयडों के लिए +3 के अतिरिक्त दूसरी ऑक्सीकरण अवस्थाओं का अस्तित्व निर्धारित करने में f0, f7 तथा f14 विन्यासों का विशेष स्थायित्व महत्त्वपूर्ण है, परंतु यह तर्क कम निर्णयात्मक हो जाता है जब हम देखते हैं कि सैमेरियम और थूलियम f6 तथा f13 विन्यास रखते हुए M2+ आयन बनाते हैं, M+ आयन नहीं।
साथ ही प्रैजियोडिमियम एवं नियोडिमियम f1 तथा f2 विन्यासों के साथ M4+ आयन बनाते हैं, परंतु कोई पंच या षट-संयोजक प्रकार के आयन नहीं बनाते। इसमें संदेह नहीं है कि Sm(II) और विशेषकर Tm(II), Pr(IV) तथा Nd(IV) अवस्थाएँ बहुत अस्थायी हैं, परंतु यह विचार भी संदिग्ध है कि f0, f7 या f14 विन्यास के केवल समीप पहुँच जाना भी स्थायित्व के लिए सहायक होता है चाहे ऐसा कोई विन्यास वस्तुतः प्राप्त नहीं भी हो। Nd2+ (f4) का अस्तित्व यह विश्वास करने के लिए विशेष निर्णयात्मक प्रमाण है कि यद्यपि f0, f7, f14 विन्यास का स्थायित्व ऑक्सीकरण अवस्थाओं का स्थायित्व निर्धारण करने में एक घटक हो सकता है, यद्यपि अन्य ऊष्मागतिकीय तथा गतिकीय घटक विशेष भी हैं जिनका समान या अधिक महत्त्व है।
APPEARS IN
RELATED QUESTIONS
लैन्थेनॉयड आकुंचन क्या है?
निम्नलिखित के संदर्भ में लैन्थेनॉयड एवं ऐक्टिनॉयड के रसायन की तुलना कीजिए।
परमाण्वीय एवं आयनिक आकार
निम्नलिखित के संदर्भ में लैन्थेनॉयड एवं ऐक्टिनॉयड के रसायन की तुलना कीजिए।
ऑक्सीकरण अवस्था
निम्नलिखित के संदर्भ में लैन्थेनॉयड एवं ऐक्टिनॉयड के रसायन की तुलना कीजिए।
रासायनिक अभिक्रियाशीलता
ऐक्टिनॉयड तत्वों का रसायन उतना नियमित नहीं है जितना कि लैन्थेनॉयड तत्वों का रसायन। इन तत्वों की ऑक्सीकरण अवस्थाओं के आधार पर इस कथन का आधार प्रस्तुत कीजिए।
लैन्थेनॉयड श्रेणी के उन सभी तत्वों का उल्लेख कीजिए जो +4 तथा जो +2 ऑक्सीकरण अवस्थाएँ दर्शाते हैं। इस प्रकार के व्यवहार तथा उनके इलेक्ट्रॉनिक विन्यास के बीच संबंध स्थापित कीजिए।
61, 91, 101 तथा 109 परमाणु क्रमांक वाले तत्वों का इलेक्ट्रॉनिक विन्यास लिखिए।
लैन्थेनॉयड धातुओं से युक्त एक प्रमुख मिश्रातु का उल्लेख कीजिए।
मिश्र धातु के उपयोग बताइए।
लैन्थेनॉयड आकुंचन के परिणाम क्या हैं?
