Advertisements
Advertisements
Question
प्रेरणिक तथा इलेक्ट्रोमेरी प्रभावों की व्याख्या कीजिए।
Solution
प्रेरणिक प्रभाव (Inductive Effect, I-effect):
भिन्न विद्युत-ऋणात्मकता के दो परमाणुओं के मध्य निर्मित सहसंयोजक आबंध में इलेक्ट्रॉन असमान रूप से सहभाजित होते हैं। इलेक्ट्रॉन घनत्व उच्च विद्युत ऋणात्मकता के परमाणु के ओर अधिक होता है। इस कारण सहसंयोजक आबंध ध्रुवीय हो जाता है। आबंध ध्रुवता के कारण कार्बनिक अणुओं में विभिन्न इलेक्ट्रॉनिक प्रभाव उत्पन्न होते हैं।
उदाहरणार्थ - क्लोरोएथेन (CH3CH2Cl) में C-Cl बंध ध्रुवीय है। इसकी ध्रुवता के कारण कार्बन क्रमांक-1 पर आंशिक धनावेश (δ+) तथा क्लोरीन पर आंशिक ऋणावेश (δ–) उत्पन्न हो जाता है। आंशिक आवेशों को दर्शाने के लिए δ (डेल्टा) चिह्न प्रयुक्त करते है। आबंध में इलेक्ट्रॉन-विस्थापन दर्शाने के लिए तीर (→) का उपयोग किया जाता है, जो δ+ से δ– की ओर आमुख होता है।
\[\ce{\overset{δδ+}{\underset{2}{CH3}}-> -\overset{δ+}{\underset{1}{CH2}} -> -\overset{δ-}{Cl}}\]
कार्बन-1 अपने आंशिक धनावेश के कारण पास के C-C आबंध के इलेक्ट्रॉनों को अपनी ओर आकर्षित करने लगता है। फलस्वरूप कार्बन-2 पर भी कुछ धनावेश (δδ+) उत्पन्न हो जाता है। C-1 पर स्थित धनावेश की तुलना में δδ+ अपेक्षाकृत कम धनावेश दर्शाता है। दूसरे शब्दों में, C-CI की ध्रुवता के कारण पास के आबंध में ध्रुवता उत्पन्न हो जाती है। समीप के σ-आबंध के कारण अगले σ-आबंध के ध्रुवीय होने की प्रक्रिया प्रेरणिक प्रभाव (inductive effect) कहलाती है। यह प्रभाव आगे के आबंधों तक भी जाता है, लेकिन आबंधों की संख्या बढ़ने के साथ-साथ यह प्रभाव कम होता जाता है और तीन आबंधों के बाद लगभग लुप्त हो जाता है। प्रेरणिक प्रभाव का संबंध प्रतिस्थापी से बंधित कार्बन परमाणु को इलेक्ट्रॉन प्रदान करने अथवा अपनी ओर आकर्षित कर लेने की योग्यता से है।इस योग्यता के आधार पर प्रतिस्थापियों को हाइड्रोजन के सापेक्ष इलेक्ट्रॉन-आकर्षी (electron-withdrawing) या इलेक्ट्रॉनदाता समूह के रूप में वर्गीकृत किया जाता है।हैलोजन तथा कुछ अन्य समूह; जैसे- नाइट्रो (–NO2), सायनो (–CN), कार्बोक्सी (–COOH), एस्टर (–COOR), ऐरिलॉक्सी (–OAr) इलेक्ट्रॉन आकर्षी समूह हैं; जबकि ऐल्किल समूह; जैसे- मेथिल (–CH3), एथिल (–CH2–CH3) आदि इलेक्ट्रॉनदाता समूह हैं।
इलेक्ट्रोमेरी प्रभाव (E प्रभाव) [Electromeric Effect, (E-effect)]:
यह एक अस्थायी प्रभाव है। केवल आक्रमणकारी अभिकारकों की उपस्थिति में यह प्रभाव बहुआबंध (द्विआबंध अथवा त्रिआबंध) वाले कार्बनिक यौगिकों में प्रदर्शित होता है।इस प्रभाव में आक्रमण करने वाले अभिकारके की माँग के कारण बहु-आबंध से बंधित परमाणुओं में एक सहभाजित π इलेक्ट्रॉन युग्म का पूर्ण विस्थापन होता है। अभिक्रिया की परिधि से आक्रमणकारी अभिकारक को हटाते ही यह प्रभाव शून्य हो। जाता है। इसे E द्वारा दर्शाया जाता है, जबकि इलेक्ट्रॉन के संचलन को वक्र तीर  द्वारा प्रदर्शित किया जाता है। स्पष्टतः दो प्रकार के इलेक्ट्रोमेरी प्रभाव होते हैं-
द्वारा प्रदर्शित किया जाता है। स्पष्टतः दो प्रकार के इलेक्ट्रोमेरी प्रभाव होते हैं-
- धनात्मक इलेक्ट्रोमेरी प्रभाव (+E प्रभाव):
इस प्रभाव में बहुआबंध के π-इलेक्ट्रॉनों का स्थानांतरण उस परमाणु पर होता है जिससे आक्रमणकारी अभिकर्मक बंधित होता है।उदाहरणार्थ-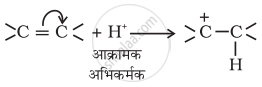
- ऋणात्मक इलेक्ट्रोमेरी प्रभाव (-E प्रभाव):
इस प्रभाव में बहु-आबंध के π-इलेक्ट्रॉनों का स्थानांतरण उस परमाणु पर होता है जिससे आक्रमणकारी अभिकर्मक बंधित नहीं होता है। इसका उदाहरण निम्नलिखित है-
जब प्रेरणिक तथा इलेक्ट्रोमेरी प्रभाव एक-दूसरे की विपरीत दिशाओं में कार्य करते हैं, तब इलेक्ट्रोमेरिक प्रभाव प्रबल होता है।
