Advertisements
Advertisements
प्रश्न
संयोजकता आबंध सिद्धांत के आधार पर H2 अणु के विरचन की व्याख्या कीजिए।
उत्तर
संयोजक्ता आबंध सिद्धांत को सर्वप्रथम हाइटलर तथा लंडन (Heitler and London) ने सन् 1927 में प्रस्तुत किया था जिसका विकास पॉलिंग (Pauling) तथा अन्य वैज्ञानिकों ने बाद में किया। इस सिद्धांत का विवेचन परमाणु कक्षकों, तत्त्वों के इलेक्ट्रॉनिक विन्यासों, परमाणु कक्षकों के अतिव्यापन और संकरण तथा विचरण (variation) एवं अध्यारोपण (superposition) के सिद्धांतों के ज्ञान पर आधारित है।
इस सिद्धांत के आधार पर H2 अणु के विरचन की व्याख्या निम्नवत् की जा सकती है-
\[\ce{H_{(g)} + H_{(g)} -> H2_{(g)} + 433 kJ mol^{-1}}\]
यह प्रदर्शित करता है कि हाइड्रोजन अणु की ऊर्जा हाइड्रोजन परमाणुओं की तुलना में कम है। सामान्यत: जब कभी परमाणु संयोजित होकर अणु बनाते हैं, तब ऊर्जा में अवश्य ही कमी आती है जो स्थायित्व को बढ़ा देती है।
मानो हाइड्रोजन के दो परमाणु A व B, जिनके नाभिक क्रमशः NA व NB हैं तथा उनमें उपस्थित इलेक्ट्रॉनों को eA और eB द्वारा दर्शाया गया है, एक-दूसरे की ओर बढ़ते हैं। जब ये दो परमाणु एक-दूसरे से अत्यधिक दूरी पर होते हैं, तब उनके बीच कोई अन्योन्य क्रिया नहीं होती। ज्यों-ज्यों दोनों परमाणु एक-दूसरे के समीप आते-जाते हैं, त्यों-त्यों उनके बीच आकर्षण तथा प्रतिकर्षण बल उत्पन्न होते जाते हैं।
आकर्षण बल निम्नलिखित में उत्पन्न होते हैं-
- एक परमाणु के नाभिक तथा उसके इलेक्ट्रॉनों के बीच NA – eA, NB – eB
- एक परमाणु के नाभिक तथा दूसरे परमाणु के इलेक्ट्रॉनों के बीच NA – eB, NB – eA
इसी प्रकार प्रतिकर्षण बल निम्नलिखित में उत्पन्न होते हैं-
- दो परमाणुओं के इलेक्ट्रॉनों के बीच eA – eB तथा
- दो परमाणुओं के नाभिकों के बीच NA – NB।
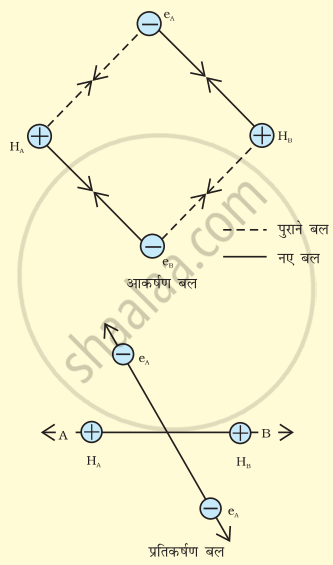
H2 अणु के विरचन में आकर्षण तथा प्रतिकर्षण बल
आकर्षण बल दोनों परमाणुओं को एक-दूसरे के पास लाते हैं, जबकि प्रतिकर्षण बल उन्हें दूर करने का प्रयास करते हैं।
प्रायोगिक तौर पर यह पाया गया है कि नए आकर्षण बलों का मान नए प्रतिकर्षण बलों के मान से अधिक होता है। इसके परिणामस्वरूप दोनों परमाणु एक-दूसरे के समीप आते हैं तथा उनकी स्थितिज ऊर्जा कम हो जाती है। अंततः ऐसी स्थिति आ जाती है कि नेट आकर्षण बल, प्रतिकर्षण बल के बराबर हो जाता है और निकाय की ऊर्जा न्यून स्तर पर पहुँच जाती है। इस अवस्था में हाइड्रोजन के परमाणु ‘आबंधित’ कहलाते हैं और एक स्थायी अणु बनाते हैं जिसकी आबंध-लंबाई 74 pm होती है।
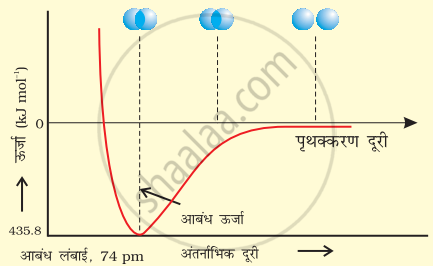
H2 अणु के विरचन के लिए H परमाणुओं के बीच अंतरानाभिक दूरी की सापेक्ष स्थितिज ऊर्जा का आरेख, आरेख में न्यूनतम ऊर्जा स्थिति H2 की सर्वाधिक स्थायी अवस्था दर्शाती है।
चूँकि हाइड्रोजन के दो परमाणुओं के बीच आबंध बनने पर ऊर्जा मुक्त होती है, इसलिए हाइड्रोजन अणु दो पृथक् परमाणुओं की अपेक्षा अधिक स्थायी होता है। इस प्रकार मुक्त ऊर्जा ‘आबंध एन्थैल्पी’ कहलाती है।
यह चित्र में दिए गए आरेख के संगत होती है। विलोमत: H2 के एक मोल अणुओं के वियोजन के लिए 433 kJ ऊर्जा की आवश्यकता होती है, इसे आबंध वियोजन ऊर्जा कहा जाता है।
\[\ce{H2_{(g)} 433 kJ mol^{-1} -> H_{(g)} + H_{(g)}}\]
APPEARS IN
संबंधित प्रश्न
संयोजकता आबंध सिद्धांत के आधार पर समझाइए कि वर्ग समतलीय संरचना वाला [Ni(CN)4]2− आयन प्रतिचुंबकीय है तथा चतुष्फलकीय ज्यामिति वाला [NiCl4]2− आयन अनुचुंबकीय है।
[NiCl4]2− अनुचुंबकीय है, जबकि [Ni(CO)4] प्रतिचुंबकीय है यद्यपि दोनों चतुष्फलकीय हैं। क्यों?
संयोजकता आबंध सिद्धांत के आधार पर निम्नलिखित उपसहसंयोजन सत्ता में आबंध की प्रकृति की विवेचना कीजिए –
[Fe(CN)6]4−
संयोजकता आबंध सिद्धांत के आधार पर निम्नलिखित उपसहसंयोजन सत्ता में आबंध की प्रकृति की विवेचना कीजिए –
[FeF6]3−
संयोजकता आबंध सिद्धांत के आधार पर निम्नलिखित उपसहसंयोजन सत्ता में आबंध की प्रकृति की विवेचना कीजिए –
[Co(C2O4)3]3−
संयोजकता आबंध सिद्धांत के आधार पर निम्नलिखित उपसहसंयोजन सत्ता में आबंध की प्रकृति की विवेचना कीजिए –
[CoF6]3−
[Cr(NH3)6]3+ अनुचुंबकीय है, जबकि [Ni(CN)4]2− प्रतिचुंबकीय, समझाइए क्यों?
ध्रुवीय सहसंयोजी आबंध से आप क्या समझते हैं? उदाहरण सहित व्याख्या कीजिए।
निम्नलिखित अणु में सिग्मा (σ) तथा पाई (π) आबंधों की कुल संख्या कितनी है?
C2H2
निम्नलिखित अणु में सिग्मा (σ) तथा पाई (π) आबंधों की कुल संख्या कितनी है?
C2H4
