Advertisements
Advertisements
Question
अभिकथन - उत्प्रेरक की उपस्थिति में अभिक्रिया की एन्थैल्पी स्थिर रहती है।
तर्क - अभिक्रिया में भाग लेने वाला उत्प्रेरक भिन्न सक्रियण संकुल बनाता है तथा सक्रियण ऊर्जा को कम करता है परन्तु अभिक्रियकों एवं उत्पादों की ऊर्जा समान रहती है।
Options
अभिकथन और तर्क दोनों सही हैं और तर्क अभिकथन का सही स्पष्टीकरण है।
अभिकथन और तर्क दोनों सही कथन हैं परन्तु तर्क अभिकथन का स्पष्टीकरण नहीं है।
अभिकथन सही है परन्तु तर्क गलत कथन है।
अभिकथन और तर्क दोनों ही गलत कथन हैं।
अभिकथन गलत है परन्तु तर्क सही कथन है।
Solution
अभिकथन और तर्क दोनों सही हैं और तर्क अभिकथन का सही स्पष्टीकरण है।
स्पष्टीकरण -
अभिक्रिया की तापीय धारिता अभिक्रियाओं की कुल तापीय धारिता का अंतर है और उत्पाद उत्प्रेरक की उपस्थिति में स्थिर रहता है।
अभिक्रिया में भाग लेने वाले उत्प्रेरक के रूप में विभिन्न सक्रिय परिसर बनते हैं और सक्रियण ऊर्जा कम हो जाती है, लेकिन अभिकारक और उत्पाद की ऊर्जा में अंतर समान रहता है।
APPEARS IN
RELATED QUESTIONS
विभिन्न तापों पर N2O5 के अपघटन के लिए वेग स्थिरांक नीचे दिए गए हैं –
| T/°C | 0 | 20 | 40 | 60 | 80 |
| 105 × k/s–1 | 0.0787 | 1.70 | 25.7 | 178 | 2140 |
In k एवं 1/T के मध्य ग्राफ खींचिए तथा A एवं Ea की गणना कीजिए। 30°C तथा 50°C पर वेग स्थिरांक को प्रागुक्त कीजिए।
546 K ताप पर एक हाइड्रोकार्बन के अपघटन में वेग स्थिरांक 2.418 × 10−5 s−1 है। यदि सक्रियण ऊर्जा 179.9 kJ mol−1 हो तो पूर्व-घातांकी गुणन का मान क्या होगा?
किसी अभिक्रिया \[\ce{A -> {उत्पाद}}\] के लिए k = 2.0 × 10−2 s−1 है। यदि A की प्रारंभिक सांद्रता 1.0 mol L−1 हो तो 100 s पश्चात् इसकी सांद्रता क्या रह जाएगी?
ताप में 293 K से 313 K तक वृद्धि करने पर किसी अभिक्रिया का वेग चार गुना हो जाता है। इस अभिक्रिया के लिए सक्रियण ऊर्जा की गणना यह मानते हुए कीजिए कि इसका मान ताप के साथ परिवर्तित नहीं होता।
निम्नलिखित में से कौन-सा ग्राफ ऊष्माक्षेपी अभिक्रिया को प्रदर्शित करता है-
(क)
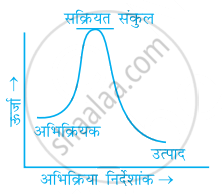
(ख)
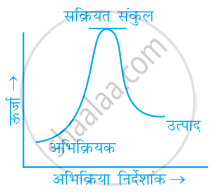
(ग)
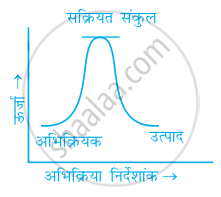
गलत कथनों को चिह्नित कीजिए।
- उत्प्रेरक अभिक्रिया को वैकल्पिक पथ उपलब्ध कराता है।
- उत्प्रेरक सक्रियण ऊर्जा को बढाता है।
- उत्प्रेरक सक्रियण ऊर्जा को कम करता है।
- उत्प्रेरक अभिक्रिया के एन्थैल्पी परिवर्तन को बदल देता है।
अभिक्रिया में अणुओं के बहुत बड़े अंश की ऊर्जा देहली ऊर्जा से अधिक है फिर भी अभिक्रिया वेग बहुत कम है, ऐसा क्यों है?
स्पष्ट कीजिए कि H2(g) तथा O2(g) के मध्य अभिक्रिया अति संभाव्य है परन्तु गैसों को एक ही पात्र में कमरे के ताप पर रखने से जल क्यों नहीं बनता।
तीन से अधिक आणिकता वाली अभिक्रियाओं की संभावनाएँ बहुत कम क्यों होती हैं?
ऑक्सैलिक अम्ल तथा KMnO4 के मध्य ऑक्सीकरण-अपचयन अनुमापन में हम अनुमापन प्रारम्भ करने से पूर्व ऑक्सैलिक अम्ल विलयन को गरम क्यों करते हैं?
