Advertisements
Chapters
2: परमाणु की संरचना
3: तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
▶ 4: रासायनिक आबंधन तथा आण्विक संरचना
5: द्रव्य की अवस्थाएँ
6: ऊष्मागतिकी
7: साम्यावस्था
8: अपचयोपचय अभिक्रियाएँ
9: हाइड्रोजन
10: s-ब्लॉक तत्त्व
11: p-ब्लॉक तत्त्व
12: कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें
13: हाइड्रोकार्बन
14: पर्यावरणीय रसायन
![NCERT solutions for Chemistry - Part 1 and 2 [Hindi] Class 11 chapter 4 - रासायनिक आबंधन तथा आण्विक संरचना NCERT solutions for Chemistry - Part 1 and 2 [Hindi] Class 11 chapter 4 - रासायनिक आबंधन तथा आण्विक संरचना - Shaalaa.com](/images/chemistry-part-1-and-2-hindi-class-11_6:134c1ea964064b77973b84538c3adc59.jpg)
Advertisements
Solutions for Chapter 4: रासायनिक आबंधन तथा आण्विक संरचना
Below listed, you can find solutions for Chapter 4 of CBSE NCERT for Chemistry - Part 1 and 2 [Hindi] Class 11.
NCERT solutions for Chemistry - Part 1 and 2 [Hindi] Class 11 4 रासायनिक आबंधन तथा आण्विक संरचना अभ्यास [Pages 133 - 135]
रासायनिक आबंध के बनने की व्याख्या कीजिए।
निम्नलिखित तत्त्वों के परमाणुओं के लूइस बिंदु प्रतीक लिखिए-
Mg, Na, B, O, N, Br
निम्नलिखित परमाणु तथा आयन के लूइस बिंदु प्रतीक लिखिए।
S और S2−
निम्नलिखित परमाणु तथा आयन के लूइस बिंदु प्रतीक लिखिए।
AI और Al3+
निम्नलिखित परमाणु तथा आयन के लूइस बिंदु प्रतीक लिखिए।
H और H–
निम्नलिखित अणु तथा आयन की लूइस संरचनाएँ लिखिए-
H2S
निम्नलिखित अणु तथा आयन की लूइस संरचनाएँ लिखिए-
SiCl4
निम्नलिखित अणु तथा आयन की लूइस संरचनाएँ लिखिए-
BeF2
निम्नलिखित अणु तथा आयन की लूइस संरचनाएँ लिखिए-
\[\ce{CO^{2-}3}\]
निम्नलिखित अणु तथा आयन की लूइस संरचनाएँ लिखिए-
HCOOH
अष्टक नियम को परिभाषित कीजिए।
अष्टक नियम के महत्त्व और सीमाओं को लिखिए।
आयनिक आबंध बनाने के लिए अनुकूल कारकों को लिखिए।
निम्नलिखित अणुओं की आकृति की व्याख्या वी. एस. ई. पी. आर. सिद्धांत के अनुरूप कीजिए-
BeCl2, BCl3, SiCl4, AsF5, H2S, PH3
यद्यपि NH3 तथा H2O दोनों अणुओं की ज्यामिति विकृत चतुष्फलकीय होती है, तथापि जल में आबंध कोण अमोनिया की अपेक्षा कम होता है। विवेचना कीजिए।
आबंध प्रबलता को आबंध कोटि के रूप में आप किस प्रकार व्यक्त करेंगे?
आबंध लंबाई की परिभाषा दीजिए।
\[\ce{CO^{2-}_3}\] आयन के संदर्भ में अनुनाद के विभिन्न पहलुओं को स्पष्ट कीजिए।
नीचे दी गई संरचनाओं (1 तथा 2) द्वारा H3PO3 को प्रदर्शित किया जा सकता है। क्या ये दो संरचनाएँ H3PO3 के अनुनाद संकर के विहित (केनॉनीकल) रूप माने जा सकते हैं? यदि नहीं, तो उसका कारण बताइए।
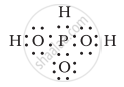 |
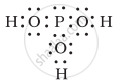 |
| (1) | (2) |
SO3 की अनुनाद संरचनाएँ लिखिए।
NO2 की अनुनाद संरचनाएँ लिखिए।
\[\ce{NO^-_3}\] की अनुनाद संरचनाएँ लिखिए।
निम्नलिखित परमाणुओं से इलेक्ट्रॉन स्थानांतरण द्वारा धनायनों तथा ऋणायनों में विरचन को लूइस बिंदु-प्रतीकों की सहायता से दर्शाइए-
K तथा S
निम्नलिखित परमाणुओं से इलेक्ट्रॉन स्थानांतरण द्वारा धनायनों तथा ऋणायनों में विरचन को लूइस बिंदु-प्रतीकों की सहायता से दर्शाइए-
Ca तथा O
निम्नलिखित परमाणुओं से इलेक्ट्रॉन स्थानांतरण द्वारा धनायनों तथा ऋणायनों में विरचन को लूइस बिंदु-प्रतीकों की सहायता से दर्शाइए-
Al तथा N
हालाँकि CO2 तथा H2O दोनों त्रिपरमाणुक अणु हैं, परंतु H2O अणु की आकृति बंकित होती है, जबकि CO2 की रैखिक आकृति होती है। द्विध्रुव आघूर्ण के आधार पर इसकी व्याख्या कीजिए।
द्विध्रुव आघूर्ण के महत्त्वपूर्ण अनुप्रयोग बताएँ।
विद्युत-ऋणात्मकता को परिभाषित कीजिए।
विद्युत-ऋणात्मकता इलेक्ट्रॉन बंधुता से किस प्रकार भिन्न है?
ध्रुवीय सहसंयोजी आबंध से आप क्या समझते हैं? उदाहरण सहित व्याख्या कीजिए।
निम्नलिखित अणुओं को आबंधों की बढ़ती आयनिक प्रकृति के क्रम में लिखिए-
LiF, K2O, N2, SO2 तथा ClF3
CH3COOH की नीचे दी गई ढाँचा-संरचना सही है, परंतु कुछ आबंध त्रुटिपूर्ण दर्शाए गए है। ऐसिटिक अम्ल की सही लूइस-संरचना लिखिए-
\[\begin{array}{cc}
\phantom{...}\ce{H}\phantom{..}\ce{:O:}\phantom{......}\\
\phantom{}|\phantom{....}|\phantom{.....}\\
\ce{H = C - \underset{\bullet\bullet}{C} - \underset{\bullet\bullet}{O} - H}\\
|\phantom{.........}\\
\ce{H}\phantom{.........}
\end{array}\]
चतुष्फलकीय ज्यामिति के अलावा CH4 अणु की एक और संभव ज्यामिति वर्ग-समतली है, जिसमें हाइड्रोजन के चार परमाणु एक वर्ग के चार कोनों पर होते हैं। व्याख्या कीजिए कि CH4 का अणु वर्ग-समतली नहीं होता है।
यद्यपि Be–H आबंध ध्रुवीय है, तथापि BeH2 अणु का द्विध्रुव आघूर्ण शून्य है। स्पष्ट कीजिए।
NH3 तथा NF3 में किस अणु का द्विध्रुव-आघूर्ण अधिक है और क्यों?
परमाणु-कक्षकों के संकरण से आप क्या समझते हैं।
sp, sp2 तथा sp3 संकर कक्षकों की आकृति का वर्णन कीजिए।
निम्नलिखित अभिक्रिया में Al परमाणु की संकरण अवस्था में परिवर्तन (यदि होता है, तो) को समझाइए-
\[\ce{AlCl3 + Cl^- -> AlCl^-_4}\]
क्या निम्नलिखित अभिक्रिया के फलस्वरूप B तथा N परमाणुओं की संकरण-अवस्था में परिवर्तन होता है?
\[\ce{BF3 + NH3 -> F3B.NH3}\]
C2H4 तथा C2H2 अणुओं में कार्बन परमाणुओं के बीच क्रमशः द्वि-आबंध तथा त्रि-आबंध के निर्माण को चित्र द्वारा स्पष्ट कीजिए।
निम्नलिखित अणु में सिग्मा (σ) तथा पाई (π) आबंधों की कुल संख्या कितनी है?
C2H2
निम्नलिखित अणु में सिग्मा (σ) तथा पाई (π) आबंधों की कुल संख्या कितनी है?
C2H4
x-अक्ष को अंतर्नाभिकीय अक्ष मानते हुए बताइए कि निम्नलिखित में कौन-से कक्षक सिग्मा (σ) आबंध नहीं बनाएँगे और क्यों?
(क) 1s तथा 1s
(ख) 1s तथा 2px
(ग) 2py तथा 2py
(घ) 1s तथा 2s
निम्नलिखित अणुओं में कार्बन परमाणु कौन-से संकर कक्षक प्रयुक्त करते हैं?
CH3–CH3
निम्नलिखित अणुओं में कार्बन परमाणु कौन-से संकर कक्षक प्रयुक्त करते हैं?
CH3–CH = CH2
निम्नलिखित अणुओं में कार्बन परमाणु कौन-से संकर कक्षक प्रयुक्त करते हैं?
CH3–CH2–OH
निम्नलिखित अणुओं में कार्बन परमाणु कौन-से संकर कक्षक प्रयुक्त करते हैं?
CH3CHO
निम्नलिखित अणुओं में कार्बन परमाणु कौन-से संकर कक्षक प्रयुक्त करते हैं?
CH3COOH
इलेक्ट्रॉनों के आबंधी युग्म तथा एकाकी युग्म से आप क्या समझते हैं? प्रत्येक के एक उदाहरण द्वारा स्पष्ट कीजिए।
सिग्मा तथा पाई आबंध में अंतर स्पष्ट कीजिए।
संयोजकता आबंध सिद्धांत के आधार पर H2 अणु के विरचन की व्याख्या कीजिए।
परमाणु कक्षकों के रैखिक संयोग से आण्विक कक्षक बनने के लिए आवश्यक शर्तों कों लिखें।
आण्विक कक्षक सिद्धांत के आधार पर समझाइए कि Be2 अणु का अस्तित्व क्यों नहीं होता?
निम्नलिखित स्पीशीज़ के आपेक्षिक स्थायित्व की तुलना कीजिए तथा उनके चुंबकीय गुण इंगित कीजिए-
\[\ce{O2, O^+_2, O^-_2}\] (सुपर ऑक्साइड) तथा \[\ce{O^{2-}_2}\] (परऑक्साइड)
कक्षकों के निरूपण में उपयुक्त धन (+) तथा ऋण (−) चिह्नों का क्या महत्त्व होता है?
PCl5 अणु में संकरण का वर्णन कीजिए। इसमें अक्षीय आबंध विषुवतीय आबंधों की अपेक्षा अधिक लंबे क्यों होते हैं?
हाइड्रोजन आबंध की परिभाषा दीजिए। यह वान्डरवाल्स बलों की अपेक्षा प्रबल होते है या दुर्बल?
'आबंध कोटि' से आप क्या समझते हैं?
निम्नलिखित में आबंध कोटि का परिकलन कीजिए-
N2, O2, \[\ce{O^+_2}\] तथा \[\ce{O^-_2}\]
Solutions for 4: रासायनिक आबंधन तथा आण्विक संरचना
![NCERT solutions for Chemistry - Part 1 and 2 [Hindi] Class 11 chapter 4 - रासायनिक आबंधन तथा आण्विक संरचना NCERT solutions for Chemistry - Part 1 and 2 [Hindi] Class 11 chapter 4 - रासायनिक आबंधन तथा आण्विक संरचना - Shaalaa.com](/images/chemistry-part-1-and-2-hindi-class-11_6:134c1ea964064b77973b84538c3adc59.jpg)
NCERT solutions for Chemistry - Part 1 and 2 [Hindi] Class 11 chapter 4 - रासायनिक आबंधन तथा आण्विक संरचना
Shaalaa.com has the CBSE Mathematics Chemistry - Part 1 and 2 [Hindi] Class 11 CBSE solutions in a manner that help students grasp basic concepts better and faster. The detailed, step-by-step solutions will help you understand the concepts better and clarify any confusion. NCERT solutions for Mathematics Chemistry - Part 1 and 2 [Hindi] Class 11 CBSE 4 (रासायनिक आबंधन तथा आण्विक संरचना) include all questions with answers and detailed explanations. This will clear students' doubts about questions and improve their application skills while preparing for board exams.
Further, we at Shaalaa.com provide such solutions so students can prepare for written exams. NCERT textbook solutions can be a core help for self-study and provide excellent self-help guidance for students.
Concepts covered in Chemistry - Part 1 and 2 [Hindi] Class 11 chapter 4 रासायनिक आबंधन तथा आण्विक संरचना are आण्विक कक्षक सिद्धांत, आण्विक कक्षकों का निर्माण - परमाणु-कक्षकों का रैखिक संयोग, परमाणु कक्षकों के संयोग की शर्तें, आण्विक कक्षकों के प्रकार, आण्विक कक्षकों का ऊर्जा-स्तर आरेख, इलेक्ट्रॉनी विन्यास तथा आण्विक व्यवहार, समनाभिकीय द्विपरमाणुक अणुओं में आबंधन, हाइड्रोजन आबंधन, हाइड्रोजन आबंध बनने का कारण, हाइड्रोजन आबंधों के प्रकार, रासायनिक आबंधन तथा आण्विक संरचना, रासायनिक आबंधन की कासेल-लुइस अवधारणा, आयनिक या वैद्युत् संयोजी आबंध, आबंध प्राचल, संयोजकता कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धांत, संयोजकता आबंध सिद्धांत, संकरण, संकरण के प्रकार, d-कक्षकों वाले तत्त्वों में संकरण, आण्विक कक्षक सिद्धांत, आण्विक कक्षकों का निर्माण - परमाणु-कक्षकों का रैखिक संयोग, परमाणु कक्षकों के संयोग की शर्तें, आण्विक कक्षकों के प्रकार, आण्विक कक्षकों का ऊर्जा-स्तर आरेख, इलेक्ट्रॉनी विन्यास तथा आण्विक व्यवहार, समनाभिकीय द्विपरमाणुक अणुओं में आबंधन, हाइड्रोजन आबंधन, हाइड्रोजन आबंध बनने का कारण, हाइड्रोजन आबंधों के प्रकार, रासायनिक आबंधन तथा आण्विक संरचना, रासायनिक आबंधन की कासेल-लुइस अवधारणा, आयनिक या वैद्युत् संयोजी आबंध, आबंध प्राचल, संयोजकता कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धांत, संयोजकता आबंध सिद्धांत, संकरण, संकरण के प्रकार, d-कक्षकों वाले तत्त्वों में संकरण.
Using NCERT Chemistry - Part 1 and 2 [Hindi] Class 11 solutions रासायनिक आबंधन तथा आण्विक संरचना exercise by students is an easy way to prepare for the exams, as they involve solutions arranged chapter-wise and also page-wise. The questions involved in NCERT Solutions are essential questions that can be asked in the final exam. Maximum CBSE Chemistry - Part 1 and 2 [Hindi] Class 11 students prefer NCERT Textbook Solutions to score more in exams.
Get the free view of Chapter 4, रासायनिक आबंधन तथा आण्विक संरचना Chemistry - Part 1 and 2 [Hindi] Class 11 additional questions for Mathematics Chemistry - Part 1 and 2 [Hindi] Class 11 CBSE, and you can use Shaalaa.com to keep it handy for your exam preparation.
